Injecția intraarticulară a tratamentului pentru osteoartrită îmbunătățită cu termogel încorporat în Kartogenin
Shao-Jie Wang
1 Departamentul de chirurgie articulară și medicină sportivă, Universitatea Xiamen Spitalul Zhongshan, Xiamen, China
Ji-Zheng Qin
1 Departamentul de chirurgie articulară și medicină sportivă, Universitatea Xiamen Spitalul Zhongshan, Xiamen, China
Tong-En Zhang
2 Facultatea de Medicină a Universității Xiamen, Xiamen, China
Chun Xia
1 Departamentul de Chirurgie Comună și Medicină Sportivă, Universitatea Xiamen Spitalul Zhongshan, Xiamen, China
Date asociate
Datele brute care susțin concluziile acestui manuscris vor fi puse la dispoziția autorilor, fără rezerve nejustificate, oricărui cercetător calificat.
Abstract
Introducere
Osteoartrita (OA) este o patologie degenerativă comună a articulațiilor care afectează 151 de milioane de oameni din întreaga lume. Injecțiile intraarticulare directe de medicamente sunt utilizate în mod obișnuit pentru a îmbunătăți biodisponibilitatea articulară, reducând în același timp complicațiile sistemice. Recent, o moleculă mică, kartogenina (KGN), a fost raportată pentru a promova sinteza colagenului (Johnson, 2012). S-a raportat că injecția intraarticulară de KGN îmbunătățește regenerarea cartilajului (Kang și colab., 2014; Mohan și colab., 2016; Fan și colab., 2018). Cu toate acestea, KGN nu poate oferi efecte terapeutice pe termen lung din cauza clearance-ului rapid și a retenției scurte a KGN în articulații, prezentând un dezavantaj în aplicarea sa clinică. Pentru a îmbunătăți timpul de ședere al agenților de tratament în articulații, cercetătorii au folosit hidrogeluri pentru eliberarea medicamentului și eliberarea controlului medicamentului (Seliktar, 2012).
Copolimerul tribloc poli (lactidă-co-glicolidă) – poli (etilen glicol) -pol (lactidă-co-glicolidă) (PLGA – PEG – PLGA) a fost utilizat ca matrice potențială de termogel și se poate dizolva în apă la temperatură scăzută (de exemplu, 4 ° C), iar soluția gelifică temperatura corpului (de exemplu, 37 ° C) (Yu și colab., 2011; Li și colab., 2012; Wang și colab., 2016c, 2019; Zhang și colab., 2019). Având în vedere avantajele posedării și modului minim invaziv de a furniza molecule bioactive, în studiul actual am folosit copolimerul PLGA-PEG-PLGA pentru a fabrica termogel încorporat cu concentrație terapeutică de KGN pentru injecție intraarticulară. Sistemul de termogel KGN a fost evaluat atât in vitro, cât și in vivo pentru a examina potențialul tratamentului cu OA. Am cultivat condrocite pre-tratate cu IL-1β pentru a imita condrocitele OA (Cui și colab., 2016) pentru a investiga efectul termogelului KGN asupra condrocitelor OA în ceea ce privește producerea și degradarea matricei cartilajului. Apoi, termogelul PLGA-PEG-PLGA cu sau fără KGN a fost injectat în genunchi OA la iepuri pentru a examina efectele termogelului KGN asupra OA.
Materiale si metode
Pregătirea termogelului PLGA – PEG – PLGA
Copolimerii tribloc PLGA – PEG – PLGA au fost cumpărați de la (Daigang Co., Ltd., Jinan, Shandong, China). Copolimerii au fost sintetizați prin polimerizarea cu deschidere inelară (ROP) a L-LA și GA cu PEG ca macroinitiator și Sn (Oct) 2 ca catalizator, după cum sa raportat anterior (Wang și colab., 2016c). Mns-urile PEG și PLGA au fost 1.500 și, respectiv, 1.400 g/mol. Raportul molar dintre L-LA și GA în segmentul PLGA este de 75:25. Copolimerii tribloc PLGA-PEG-PLGA s-au dizolvat în PBS (pH 7,4) pentru a obține o soluție de gel 20% în greutate, care a fost apoi menținută la 4 ° C înainte de a fi utilizată în următoarele experimente. Comportamentul de tranziție sol-gel al termogelului PLGA-PEG-PLGA a fost confirmat prin incubare la 37 ° C timp de 15 min.
Prepararea KGN Thermogel
Zece miligrame de KGN (Selleck Chemicals, Shanghai, China) au fost dizolvate în 0,6 ml dimetil sulfoxid (DMSO) și apoi diluate cu PBS (pH 7,4) pentru a obține 5 mM soluții de lucru KGN. KGN termogel a fost preparat prin amestecarea a 100 μl 5 mM soluție KGN cu 10 ml soluție de gel PLGA-PEG-PLGA pentru a obține o soluție de gel KGN conținând 50 μM KGN. Soluția de gel PLGA-PEG-PLGA fără KGN a fost utilizată ca martor.
Eliberare KGN in vitro
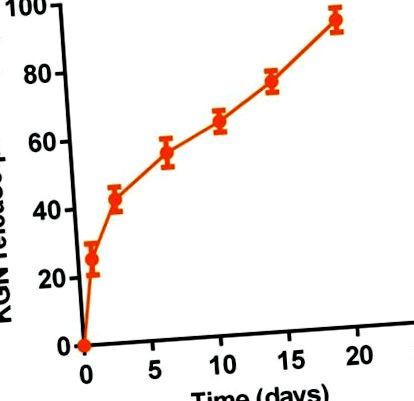
Eliberarea susținută in vitro de KGN din termogelul KGN a fost determinată de un spectrofotometru ultra-micro UV (Nanodrop 2000). Pe scurt, 1 ml de termogel 20% în greutate sau soluție de termogel KGN a fost plasat într-un flacon cu un diametru interior de 16 mm pentru gelificare la 37 ° C. Apoi s-au adăugat 2 ml PBS deasupra gelului. Supernatantul a fost colectat la intervale de timp stabilite (0,0, 1,0, 3,0, 7,0, 11,0, 15,0 și 20,0 zile). Apoi s-au înlocuit încă 2 ml PBS. Concentrațiile seriale de KGN în soluția de PBS au fost utilizate ca standarde. Măsurarea a fost efectuată cu o lungime de undă de detecție de 277 nm. Cantitatea de KGN eliberată la fiecare punct de timp a fost calculată ca procent din conținutul total de KGN al unei soluții de 1 mL 20% în greutate termogel sau soluție de termogel KGN.
Izolarea și cultura condrocitelor
Iepurii albi adulți din Noua Zeelandă, în vârstă de două luni, cu greutatea de aproximativ 1,5 kg au fost sacrificați pentru izolarea condrocitelor, așa cum s-a menționat anterior (Wang și colab., 2016a). Condrocitele primare au fost recoltate din cartilajul genunchilor și umerilor. Mai întâi, cartilajul tocat a fost digerat timp de 6 ore în 10 ml soluții 0,2% g/v de colagenază tip 2 (Gibco BRL Co. Ltd.) la 37 ° C. Suspensia celulară rezultată a fost centrifugată și resuspendată în DMEM cu conținut scăzut de glucoză suplimentat cu 10% FBS (HyCloneTM, Thermo Scientific, Australia) și 1% penicilină și streptomicină. Condrocitele izolate au fost cultivate în culturi monostrat într-un incubator umidificat la 37 ° C, 5% CO2 și 21% O2. Condrocitele din pasajul 2 au fost utilizate pentru experimentul ulterior.
Condrocite tratate cu IL-1β
Condrocitele de iepure din pasajul 2 care au atins confluența de 60-70% au fost cultivate cu mediu înfometat cu ser (DMEM/F12 suplimentat cu 1% FBS) timp de 12 ore și apoi au fost tratate cu IL-1β (10 ng/ml) timp de 2 ore următoarele experimente in vitro.
Proiectarea modelului OA pentru genunchi iepure
Acest studiu a fost realizat în conformitate cu Ghidul pentru îngrijirea și utilizarea animalelor de laborator de la Institutele Naționale de Sănătate. Protocolul a fost aprobat de Comitetul pentru etica experimentelor pe animale de la Universitatea Xiamen. Procedura de tranziție a ligamentului încrucișat anterior (ACLT) a fost efectuată pentru a induce modelul OA al genunchiului, după cum sa raportat anterior (Liu și colab., 2016). Iepurii albi din Noua Zeelandă (n = 24, vârsta de 5 luni, greutatea 2,5-3,0 kg) au fost apoi împărțiți în două grupuri (fals și ACLT). După anestezie și pregătirea de rutină, 18 iepuri au fost efectuați ACLT pe genunchii stângi și șase iepuri au fost supuși unei intervenții chirurgicale simulate. La 3 săptămâni după ACLT, iepurii au fost împărțiți în mod aleatoriu în trei grupuri (șase iepuri în fiecare grup) pentru injecție intraarticulară de soluție salină, termogel sau termogel KGN. La 6 săptămâni după intervenția chirurgicală simulată sau la 3 săptămâni după injecția intraarticulară, genunchii stângi din fiecare grup au fost recoltați pentru analize histologice și lichidul sinovial a fost colectat pentru analiza interleukinei-1 (IL-6) și a MMP-13, pentru a evalua inflamația genunchilor.
Cultura in vitro a condrocitelor tratate cu IL-1β în termogel KGN
Suspensia celulară conținând 5,0 × 105 condrocite tratate cu IL-1β a fost amestecată cu 100,0 μl de termogel sau soluție de termogel KGN la 4 ° C și apoi transferată într-o placă cu 24 de godeuri. Soluția mixtă de celule-copolimer a fost incubată la 37 ° C timp de 15 minute pentru gelificare și atașarea inițială a celulei. S-au adăugat 2,0 ml DMEM proaspăt suplimentat cu 10% (V/V) FBS (HyCloneTM, Thermo Scientific, Australia) și 1% penicilină și streptomicină (Invitrogen, Carlsbad, CA, SUA).
Pentru testul proliferării celulare și analiza conținutului ADN, termogelul încărcat cu celule a fost cultivat timp de 1 săptămână în DMEM. Mediul de cultură a fost schimbat la fiecare 2 zile. Activitatea de proliferare a celulelor a fost măsurată în zilele 1, 5 și 7 folosind un test de numărare a celulelor Kit-8 (CCK-8; Dojindo Laboratories, Kumamoto, Japonia) conform instrucțiunilor producătorilor. Pe scurt, cultura celulară (n = 3) a fost clătită ușor cu PBS și apoi scufundată într-o soluție mixtă de 10,0 μL de reactiv CCK-8 cu 90,0 μL de mediu proaspăt la 37 ° C timp de 2 ore. Citirile absorbantei la 450 nm au fost observate folosind un cititor de plăci.
Analiza biochimică
Pentru a dezvălui efectul termogelului KGN asupra condrocitelor OA, am măsurat enzima de degradare a matricei (MMP-13), componenta matricei extracelulare [colagenul de tip 2 (COL-2) și glicozaminoglicanul (GAG)] secretat din condrocitele OA. Pe scurt, specimenele au fost digerate într-o soluție pre-preparată de papaină conținând 0,5 M EDTA, 0,05 M clorhidrat de cisteină și 1,0 mg/ml enzimă papaină (Sigma, St. Louis, MO, SUA) la 60 ° C timp de 12 ore. Alicote ale digestiei probei au fost utilizate pentru măsurarea ADN și GAG, după cum sa raportat anterior (Wang și colab., 2016a). Conținutul de ADN a fost măsurat folosind un test de fluorescență. Conținutul total de glicozaminoglican (GAG) a fost determinat folosind un test de legare a colorantului 1,9-dimetilmetilen albastru (DMMB; Sigma, St. Louis, MO, SUA). Mediul de cultură al condrocitelor tratate cu IL-1β a fost colectat după 3 săptămâni de cultură în termogel KGN. Supernatantul a fost separat de reziduurile insolubile prin centrifugare la 12.000 rpm timp de 10 min. Kituri ELISA Rabbit MMP-13 și COL-2 (Cloud-Clone, Corp., Houston, TX, SUA) au fost utilizate pentru măsurarea COL-2 și MMP-13 conform instrucțiunilor producătorului. Concentrațiile GAG, COL-2 și MMP-13 au fost normalizate la conținutul de ADN care a fost determinat fluorometric folosind colorarea Hoechst așa cum s-a descris anterior (Wang și colab., 2016a).
Analize de expresie genică
Pentru a evalua efectul KGN asupra condrocitelor OA, am măsurat expresiile genelor legate de artrită și ale genelor legate de cartilaj. Expresiile genetice au fost detectate prin reacția în lanț a polimerazei în timp real (RT-PCR) așa cum sa raportat anterior (Wang și colab., 2016a). În momente de timp predesemnate, probele (n = 3) au fost omogenizate în reactivul Trizol (Invitrogen, Carlsbad, CA, SUA) cu un polizor de țesut și ARN-ul a fost extras conform instrucțiunilor producătorului. Concentrația de ARN izolat a fost determinată de un spectrofotometru ND-2000 (Nanodrop Technologies). O microgramă de ARN din fiecare probă a fost transcrisă invers în ADNc folosind kitul MMLV Reverse (Promega, Madison, WI, SUA), iar analiza RT-PCR a fost efectuată utilizând sistemul PCI în timp real ABI 7300 (Applied Biosystems, Foster City, CA, SUA) cu SYBR Green PCR Master Mix (Toyobo, Osaka, Japonia). Expresia relativă a genei a fost exprimată prin diferența de ori care a fost calculată ca 2 ΔΔCT. Modificările relative ale expresiei în aceste gene țintă au fost cuantificate prin normalizarea expresiei lor la cea a genei menajere gliceraldehidă-3-fosfat dehidrogenază (GAPDH). Primerii PCR pentru: colagen de tip 1 (COL-1), colagen de tip 2 (COL-2), aggrecan (AGC), MMP-13 și GAPDH au fost enumerați în tabelul 1 .
tabelul 1
Secvențe primare utilizate pentru PCR în timp real.
| COL-1 | TGGCAAGAACGGAGATGACG | GCACCATCCAAACCACTGAA |
| COL-2 | CCACGCTCAAGTCCCTCAAC | AGTCACCGCTCTTCCACTCG |
| AGC | CGTGGTCTGGACAGGTGCTA | GGTTGGGGTAGAGGTAGACG |
| MMP-13 | TTGACCACTCCAAGGACCCAG | GAGGATGCAGACGCCAGAAGA |
| GAPDH | CCATCACCATCTTCCAGGAG | GATGATGACCCTTTTGGCTC |
Col-1, colagen de tip 1; Col-2, colagen de tip 2; AGC, aggrecan; MMP-13, metaloproteinaza matrice 13; GAPDH, gliceraldehidă-3-fosfat dehidrogenază.
Analiza histologică
După injecția intraarticulară timp de 3 săptămâni, fiecare grup de iepuri a fost eutanasiat cu supradozaj de pentobarbital sodic. Femurul distal a fost rezecat pentru evaluare histologică. Nu a apărut nicio infecție articulară la toate genunchii. Pentru a evalua inflamația articulațiilor genunchiului, lichidul sinovial a fost colectat pentru analiza interleukinei-6 (IL-6) și a MMP-13. După disecție și fixare, probele au fost decalcificate în EDTA 15% (pH 7,2 în PBS) cu 5% paraformaldehidă la 4 ° C. Condilii mediali decalcifiați au fost apoi tăiați, deshidratați într-o serie de etanol gradat și încorporați în parafină. Secțiunile au fost colorate cu H&E, TB (pozitiv pentru proteoglicani) și colorare imunohistochimică (IHC) (pozitiv pentru COL-2). Protocoalele pentru detectarea COL-2 au fost descrise în secțiunile de mai sus. Secțiunile histologice au fost revizuite orbește pentru evaluarea cantitativă a distrugerii cartilajului utilizând sistemul de notare Osteoarthritis Research Society International (OARSI) (Pritzker și colab., 2006).
Analize statistice
Eliberare KGN susținută in vitro din termogel KGN (20,0% în greutate) în PBS (pH 7,4) la 37 ° C (n = 3).
Viabilitatea și proliferarea celulară
După cultura în mediu de creștere timp de 72 de ore, testul CCK a arătat că condrocitele OA au proliferat atât în termogelul PLGA-PEG-PLGA, cât și în termogelul KGN au arătat o proliferare crescută pe parcursul a 7 zile de cultură in vitro (Figura 2A). Cu toate acestea, numărul de condrocite OA în termogel și termogel KGN în ziua 7 nu a diferit semnificativ, comparativ cu cel din ziua 1 (p> 0,05). În special, numărul MSC din termogelul KGN a depășit ușor pe cel din termogel.
Proliferarea celulelor in vitro și producerea componentelor matricei. (A) Testul CCK-8 a arătat că proliferarea condrocitelor tratate cu IL-1β în termogel sau termogel KGN a crescut în timp (B) Conținutul GAG a fost măsurat prin test DMMB, COL-2 și MMP-13 au fost determinate prin ELISA după ce condrocitele tratate cu IL-1β au fost cultivate în termogel sau termogel KGN timp de 2 săptămâni (n = 3, * P Figura 2B). O cantitate semnificativ mai mare de GAG și COL-2 a fost detectată în termogelul KGN decât cea din grupul termogel (p Figura 3). O mai mare reglare a genelor specifice cartilajului hialin COL-2 și AGC au fost detectate în sistemul termogel KGN decât cel din termogel fără KGN (p Figura 4). Degenerarea ușoară a cartilajului a fost observată în grupul simulat cu hipertrofie condrocitară și grupare. Important, am remarcat un efect condroprotector distinct al termogelului KGN în grupul de gel OA + KGN, care a arătat fisuri verticale superficiale ale cartilajului superficial, depleție localizată de proteoglicani și pierderi parțiale de COL-2 în zone limitate ale cartilajului. În comparație, ambele grupuri cu termogel OA și OA + au prezentat modificări severe ale OA, cu denudare și deformare semnificativă a cartilajului, precum și proteoglican marcat și depleție COL-2. Aceste date au sugerat că injecția IA de KGN a arătat un efect antiinflamator și a favorizat regenerarea cartilajului, comparativ cu injecția IA de soluție salină sau termogel.
Colorare histologică a genunchiului OA tratat cu soluție salină (OA), termogel (OA + Gel) și termogel KGN (gel OA + KGN) la 6 săptămâni după intervenția chirurgicală ACLT. (ANUNȚ) EL, (E-H) albastru de toluidină (TB) și (I – L) imunohistochimie (IHC) COL-2 colorare.
Metoda ELISA care detectează conținutul de IL-6 și MMP-13 în lichidul sinovial al tuturor grupurilor la 6 săptămâni (n = 8, * p Figura 6, scorurile OARSI au fost semnificativ mai mici în grupul fals și în grupul OA + KGN decât cele ale OA și OA + Grupuri cu gel (p 0,05). Aceste date au sugerat artrita în curs de desfășurare și distrugerea cartilajului în grupul OA și grupul OA + Gel și artrita calmată și cartilajul regenerat în genunchii artritici tratați cu termogel KGN.
- Diagnosticul osteoartritei genunchiului, tratamentul și factorii asociați de progresie partea II
- Dieta low-FODMAP pentru tratamentul sindromului intestinului iritabil
- Este o dietă vegană Cel mai bun pentru tratamentul cu Candida
- Tratamentul GPL ajută la scăderea în greutate; Adevărat sau mit »Cum să slăbești rapid
- Stimularea electrică de joasă frecvență atenuează atrofia musculară în BCK - un tratament potențial